亜鉛とは
1.亜鉛の物理的性質
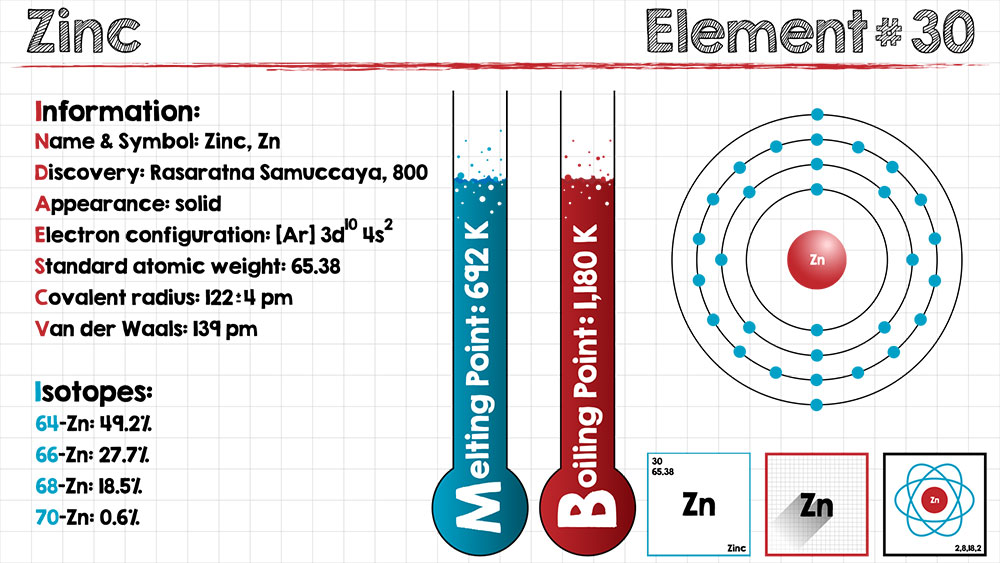
物質の物理的な性質は、物質内を動き回る電子の振る舞いによって決まります。
| 原子番号 | 30 |
|---|---|
| 元素記号 | Zn |
| 原子量 | 65.38 |
| 比重 | 7.14 |
| 融点 | 419.5℃ |
| 沸点 | 907℃ |
2.亜鉛の化学的性質
- 硫酸、塩酸に緩やかに溶解し、硝酸には良く溶ける。また酢酸、アンモニアにもゆっくりではあるが溶解する。
- 乾燥した空気中では、ほとんど酸化しないが、湿った空気中および炭酸ガスが存在する場合、表面に塩基性炭酸亜鉛の薄い皮膜が生じる。
- 鉄や鋼に比べてイオン化傾向が大きいため、それらの金属に接触させておけば、その腐食を防げる。
- 融点が低いことから寸法精度の高い鋳造品(ダイカスト他)に加工しやすい。
- 生体内の亜鉛は、糖および脂質の代謝に重要である。欠乏症は、成長の抑制あるいは停止、皮膚および附属器官の障害、生殖機能と発育不全、食欲不振などを起す。そのため動植物の成長には必須の元素である。
3.亜鉛の製法
亜鉛鉱石からまず不純物を取除く処理をして、亜鉛分が約50%の亜鉛精鉱に加工します。それらを次の2種類の方法で製錬します。
- 乾式法(蒸留法)
- 精鉱を焙焼させ酸化亜鉛焼結鉱とした後でコークスと混合加熱、亜鉛の低い沸点(907℃)を利用し酸化亜鉛中の亜鉛だけを蒸発させて取り出す方法。
この方法で製造した亜鉛を蒸留亜鉛(亜鉛分98.6%)といいます。
- 湿式法(電気分解法)
- 酸化亜鉛焼結鉱までは、蒸留法と同様。それを硫酸に溶解させ硫酸亜鉛溶液とし、この溶液から電気分解によって電極に付着した金属亜鉛を回収する方法。
この方法で製造した亜鉛を電気亜鉛(亜鉛分99.99%)といいます。
4.亜鉛の用途
亜鉛は、その性質を利用してさまざまな分野で使われています。ここでは、その代表例を紹介します。
1.鉄を守る
- 鍍金(めっき)
世界共通の鉄の防錆加工法。鋼材に亜鉛皮膜を作ることで、犠牲防食作用により錆から守ります。
市原工場においても組立てられた全ての鉄骨や集塵設備、側溝のグレーチングなど溶融亜鉛めっきが施工されています。
- 亜鉛末
- 亜鉛粉末を塗料に混合し、鋼材の防食塗装や亜鉛メッキ製品の補修に使用します。(ジンクリッチ塗料)
- 防食亜鉛
- 別名アノードと呼ばれ、鋼材の必要なところに取り付け鉄との電位差によりイオン化傾向が異なる性質を利用し、鉄の犠牲となって腐食を守ります。
2.融点が低く加工しやすい
- ダイカスト
- アルミやマグネシウムなどと混ぜた合金。強度と流動性が特長で、主に玩具、ドアノブなどの日用品や、家電製品、自動車、通信機器などの精密部品や工業用品として様々な用途で使用されます。
3.工業用・農業・医薬品に
- 亜鉛華/酸化亜鉛(ZnO)
- ゴムの硬化用、白色塗料、医薬品(軟膏薬、UVローション、ベビーパウダー、サプリメント等)の原料に使用されます。
- 塩化亜鉛(ZnCl2)
- フラックス、乾電池、農薬、試薬の原料に使用されます。
4.他の金属との合金
- 黄銅/伸銅(Cu-Zn)
銅との合金で真ちゅうとも呼ばれます。板・条・棒に加工され、バルブや給排水金具他、電気部品、建築部品、金管楽器等 様々な用途に使用されます。


